
Papel do níquel na nodulação e produtividade da soja
O níquel (Ni) é um elemento essencial para o crescimento das plantas e desempenha um papel importante no metabolismo do nitrogênio e na fixação biológica

O níquel (Ni) é um elemento essencial para o crescimento das plantas e desempenha um papel importante no metabolismo do nitrogênio e na fixação biológica

A compactação do solo afeta o cultivo global de culturas, reduzindo a penetração das raízes nas camadas superiores e mais profundas do solo. As práticas
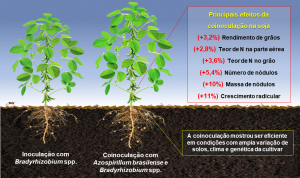
Figura 1. Principais efeitos da coinoculação de Azospirillum brasilense (Ab-V5 e Ab-V6) e Bradyrhizobium spp. na soja com base em 51 publicações com experimentos de

Figura 1. Quantidade de inoculantes comercializados (doses) no Brasil de 2009 até 2018. Fonte: Adaptado de Anpii (2021). Estima-se que a fixação biológica de nitrogênio

itro na Fixação Biológica do NitrogênioFigura 1. Experimento em casa de vegetação com mutantes de soja para a enzima urease sob fertilização de níquel para
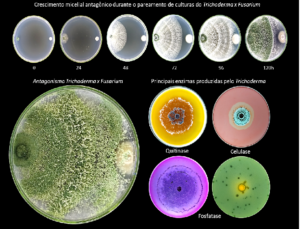
Figura 1. Crescimento micelial e principais enzimas produzidas pelo Trichoderma, quitinase, celulase e fosfatase. Foto: Cleverson Rodrigues. Experimentos desenvolvidos pelo GEFA (Grupo de Estudos em

Figura 1. A seca no passado, presente e futuro do clima global, agricultura e segurança alimentar. (A) A maioria dos cenários preveem que a escassez
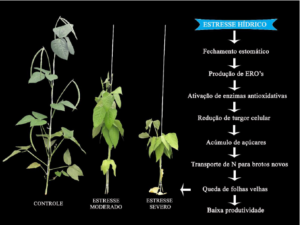
Figura 1. Sintoma visual do efeito do déficit hídrico moderado e severo na cultura do feijão-caupi (Vigna unguiculata) genótipo BRS Guariba. Foto: Andressa Melo. A seca
Mande uma mensagem pelo WhatsApp